在蛋白質研究與應用中,“精準標記”與“定向功能化”是突破技術瓶頸的關鍵,不僅要保證蛋白質天然活性不受影響,又要實現修飾分子的位點可控、高效偶聯。對于傳統化學偶聯的隨機修飾、產物不均一問題,長期制約著蛋白質在科研與產業(yè)中的價值釋放。而分選酶A(SortaseA)介導的生物偶聯技術,以其“位點精準、反應溫和、普適性強”的獨特優(yōu)勢,業(yè)已成為蛋白質標記與功能化領域的“明星技術”,為各類應用場景提供了標準化解決方案。
一、蛋白質修飾的“精準導航系統”
分選酶A具有嚴格的“底物識別-催化偶聯”機制:
識別精準性:僅特異性結合目標蛋白上的LPXTG短肽標簽,修飾分子需攜帶互補的甘氨酸序列,形成“鎖鑰式”配對。
反應溫和性:無需高溫、強酸堿或有毒化學催化劑,在生理條件下(pH6.5-8.0、室溫)即可高效反應。
偶聯穩(wěn)定性:催化形成的肽鍵在體內外均具備高度穩(wěn)定性,不易水解或脫靶,解決了傳統化學偶聯(如馬來酰亞胺-巰基反應)中修飾分子易脫落的問題。
二、蛋白質標記與功能化的關鍵應用場景
①熒光標記與動態(tài)追蹤:Dillard KE等人研究提出了一種分選酶介導的CRISPR-Cas復合物熒光標記方案,其利用分選酶識別蛋白N端或C端的短肽標簽,將小型熒光肽定點偶聯到CRISPR復合物上。這種標記方式避免了傳統標記中苛刻條件或大分子表位對CRISPR復合物活性的破壞,且分選酶在高離子強度、4℃等溫和條件下仍保持活性,兼容多種有機熒光團。標記后的復合物可用于DNA幕簾技術中的單分子熒光成像,實現對CRISPR-Cas復合物與DNA相互作用的動態(tài)追蹤【1】
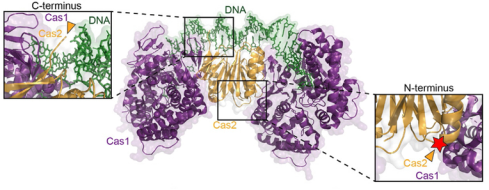
圖:N-terminal sortase labeling of Cas1-Cas2. Structure of Cas1-Cas2 complexed with DNA
②生物素標記與高靈敏度檢測:有研究首次證實分選酶A的非典型異肽連接活性可用于重組蛋白修飾。實驗中,研究者用生物素修飾的LPETG肽作為底物,在分選酶A催化下,將生物素特異性偶聯到Fn3-PLN3-ELP融合蛋白的菌毛結構域賴氨酸上,之后通過鏈霉親和素-Cy5進行免疫印跡檢測,結合SDS-PAGE和基質輔助激光解吸電離飛行時間質譜驗證,只有含菌毛結構域和生物素修飾LPETG肽的反應體系才會出現目標蛋白的生物素化條帶。該方式實現了生物素對蛋白特定位點的精準標記,借助鏈霉親和素系統達成了目標蛋白的高靈敏度鑒定?!?】

圖:Sortase A catalyzes protein-small molecule isopeptide ligation
③位點特異性交聯:為實時觀察流感病毒出芽過程中糖蛋白的動態(tài),研究者采用分選酶A介導的位點特異性標記策略。研究者先對流感病毒的血凝素(HA)和神經氨酸酶(NA)這兩種糖蛋白進行基因修飾,使其攜帶LPXTG識別序列。隨后用分選酶A催化含特定功能基團的寡甘氨酸探針與糖蛋白交聯標記。該標記方式可在感染狀態(tài)下特異性標記病毒糖蛋白,且不影響病毒活性,成功實現對活細胞內流感病毒糖蛋白的定位追蹤,為解析病毒包膜成分組裝及病毒顆粒形成的分子機制提供了關鍵工具?!?】

圖: Structural representation of sortase cleavage site mutations in hemagglutinin and neuraminidase
分選酶A正以其“位點精準、反應溫和、普適性強”的獨特優(yōu)勢,正重新塑造蛋白質標記與功能化的技術標準。無論是科研還是企業(yè)需求,分選酶A都提供了最優(yōu)選擇,因此正成為推動蛋白質科學與生物產業(yè)創(chuàng)新的核心動力!
產品訂購
產品名稱 | 產品貨號 | 包裝規(guī)格 |
Seebio? 分選酶A(Sortase A) | ECE0720A | 50μg/100μg/1mg/支 |
相關產品
產品名稱 | 產品貨號 | 包裝規(guī)格 |
Seebio? 重組煙草蝕紋病毒蛋白酶(TEV酶) | EBY3644B | 5mg/10mg |
Seebio?TEV 蛋白酶(TEV Protease)活性測定試劑盒(熒光法) | EKM0101B | 50T |
SUMO 蛋白酶(凍干粉) | EAE0087A | 1mg |
重組腸激酶 | ECE1123A | 100U |
大腸桿菌表達重組腸激酶(不帶標簽) | DAA1065A | 100U |
重組HRV 3C蛋白酶 | FCE1220A | 1KU |
參考文獻
【1】Dillard KE, Schaub JM, Brown MW, Saifuddin FA, Xiao Y, Hernandez E, Dahlhauser SD, Anslyn EV, Ke A, Finkelstein IJ. Sortase-mediated fluorescent labeling of CRISPR complexes. Methods Enzymol. 2019;616:43-59. doi: 10.1016/bs.mie.2018.10.031.
【2】Bellucci JJ, Bhattacharyya J, Chilkoti A. A noncanonical function of sortase enables site-specific conjugation of small molecules to lysine residues in proteins. Angew Chem Int Ed Engl. 2015 Jan 7;54(2):441-5. doi: 10.1002/anie.201408126.
【3】Popp MW, Karssemeijer RA, Ploegh HL. Chemoenzymatic site-specific labeling of influenza glycoproteins as a tool to observe virus budding in real time. PLoS Pathog. 2012;8(3):e1002604. doi: 10.1371/journal.ppat.1002604.
在蛋白質研究與應用中,“精準標記”與“定向功能化”是突破技術瓶頸的關鍵,不僅要保證蛋白質天然活性不受影響,又要實現修飾分子的位點可控、高效偶聯。對于傳統化學偶聯的隨機修飾、產物不均一問題,長期制約著蛋白質在科研與產業(yè)中的價值釋放。而分選酶A(SortaseA)介導的生物偶聯技術,以其“位點精準、反應溫和、普適性強”的獨特優(yōu)勢,業(yè)已成為蛋白質標記與功能化領域的“明星技術”,為各類應用場景提供了標準化解決方案。
一、蛋白質修飾的“精準導航系統”
分選酶A具有嚴格的“底物識別-催化偶聯”機制:
識別精準性:僅特異性結合目標蛋白上的LPXTG短肽標簽,修飾分子需攜帶互補的甘氨酸序列,形成“鎖鑰式”配對。
反應溫和性:無需高溫、強酸堿或有毒化學催化劑,在生理條件下(pH6.5-8.0、室溫)即可高效反應。
偶聯穩(wěn)定性:催化形成的肽鍵在體內外均具備高度穩(wěn)定性,不易水解或脫靶,解決了傳統化學偶聯(如馬來酰亞胺-巰基反應)中修飾分子易脫落的問題。
二、蛋白質標記與功能化的關鍵應用場景
①熒光標記與動態(tài)追蹤:Dillard KE等人研究提出了一種分選酶介導的CRISPR-Cas復合物熒光標記方案,其利用分選酶識別蛋白N端或C端的短肽標簽,將小型熒光肽定點偶聯到CRISPR復合物上。這種標記方式避免了傳統標記中苛刻條件或大分子表位對CRISPR復合物活性的破壞,且分選酶在高離子強度、4℃等溫和條件下仍保持活性,兼容多種有機熒光團。標記后的復合物可用于DNA幕簾技術中的單分子熒光成像,實現對CRISPR-Cas復合物與DNA相互作用的動態(tài)追蹤【1】

圖:N-terminal sortase labeling of Cas1-Cas2. Structure of Cas1-Cas2 complexed with DNA
②生物素標記與高靈敏度檢測:有研究首次證實分選酶A的非典型異肽連接活性可用于重組蛋白修飾。實驗中,研究者用生物素修飾的LPETG肽作為底物,在分選酶A催化下,將生物素特異性偶聯到Fn3-PLN3-ELP融合蛋白的菌毛結構域賴氨酸上,之后通過鏈霉親和素-Cy5進行免疫印跡檢測,結合SDS-PAGE和基質輔助激光解吸電離飛行時間質譜驗證,只有含菌毛結構域和生物素修飾LPETG肽的反應體系才會出現目標蛋白的生物素化條帶。該方式實現了生物素對蛋白特定位點的精準標記,借助鏈霉親和素系統達成了目標蛋白的高靈敏度鑒定。【2】

圖:Sortase A catalyzes protein-small molecule isopeptide ligation
③位點特異性交聯:為實時觀察流感病毒出芽過程中糖蛋白的動態(tài),研究者采用分選酶A介導的位點特異性標記策略。研究者先對流感病毒的血凝素(HA)和神經氨酸酶(NA)這兩種糖蛋白進行基因修飾,使其攜帶LPXTG識別序列。隨后用分選酶A催化含特定功能基團的寡甘氨酸探針與糖蛋白交聯標記。該標記方式可在感染狀態(tài)下特異性標記病毒糖蛋白,且不影響病毒活性,成功實現對活細胞內流感病毒糖蛋白的定位追蹤,為解析病毒包膜成分組裝及病毒顆粒形成的分子機制提供了關鍵工具?!?】

圖: Structural representation of sortase cleavage site mutations in hemagglutinin and neuraminidase
分選酶A正以其“位點精準、反應溫和、普適性強”的獨特優(yōu)勢,正重新塑造蛋白質標記與功能化的技術標準。無論是科研還是企業(yè)需求,分選酶A都提供了最優(yōu)選擇,因此正成為推動蛋白質科學與生物產業(yè)創(chuàng)新的核心動力!
產品訂購
產品名稱 | 產品貨號 | 包裝規(guī)格 |
Seebio? 分選酶A(Sortase A) | ECE0720A | 50μg/100μg/1mg/支 |
相關產品
產品名稱 | 產品貨號 | 包裝規(guī)格 |
Seebio? 重組煙草蝕紋病毒蛋白酶(TEV酶) | EBY3644B | 5mg/10mg |
Seebio? TEV 蛋白酶(TEV Protease)活性測定試劑盒(熒光法) | EKM0101B | 50T |
SUMO 蛋白酶(凍干粉) | EAE0087A | 1mg |
重組腸激酶 | ECE1123A | 100U |
大腸桿菌表達重組腸激酶(不帶標簽) | DAA1065A | 100U |
重組HRV 3C蛋白酶 | FCE1220A | 1KU |
參考文獻
【1】Dillard KE, Schaub JM, Brown MW, Saifuddin FA, Xiao Y, Hernandez E, Dahlhauser SD, Anslyn EV, Ke A, Finkelstein IJ. Sortase-mediated fluorescent labeling of CRISPR complexes. Methods Enzymol. 2019;616:43-59. doi: 10.1016/bs.mie.2018.10.031.
【2】Bellucci JJ, Bhattacharyya J, Chilkoti A. A noncanonical function of sortase enables site-specific conjugation of small molecules to lysine residues in proteins. Angew Chem Int Ed Engl. 2015 Jan 7;54(2):441-5. doi: 10.1002/anie.201408126.
【3】Popp MW, Karssemeijer RA, Ploegh HL. Chemoenzymatic site-specific labeling of influenza glycoproteins as a tool to observe virus budding in real time. PLoS Pathog. 2012;8(3):e1002604. doi: 10.1371/journal.ppat.1002604.



