摘要:研究揭示了遺傳和可調(diào)控因素通過脂代謝、氨基酸、膽汁酸等通路影響T2D發(fā)病機制的分子基礎(chǔ)。
研究團隊對十項前瞻性隊列中23,634名基線無T2D的參與者進行了長達26年的隨訪,共發(fā)現(xiàn)4,000例新發(fā)T2D病例。通過檢測469種血液代謝物,鑒定出235種與T2D風(fēng)險顯著相關(guān)的代謝物(錯誤發(fā)現(xiàn)率FDR<0.05),包括67種此前未報告的關(guān)聯(lián)代謝物,涉及膽汁酸、脂質(zhì)、肉堿、尿素循環(huán)、精氨酸/脯氨酸、甘氨酸和組氨酸等代謝途徑。多因素調(diào)整后,除葡萄糖外,代謝物與T2D的風(fēng)險比(RR)范圍為0.67(C22:4膽固醇酯)至1.71(C32:0二?;视停?。敏感性分析和不同種族/民族亞組分析結(jié)果一致,凸顯了這些代謝物關(guān)聯(lián)的穩(wěn)健性。

圖1 PARP抑制通過轉(zhuǎn)錄與代謝重編程促進CD8+中央記憶性T細胞擴增
在復(fù)雜脂質(zhì)類別中,130種脂質(zhì)與T2D風(fēng)險相關(guān),包括與能量儲存相關(guān)的三?;视停═AG)、參與胰島素抵抗信號激活的二?;视停―AG)、促進β細胞凋亡的神經(jīng)酰胺,以及與胰島素抵抗相關(guān)的磷脂酰膽堿(PC)、磷脂酰乙醇胺(PE)和磷脂酰肌醇等。相反,膽固醇酯(CE)、溶血磷脂、不飽和磷脂縮醛及部分鞘磷脂與較低T2D風(fēng)險相關(guān)。脂質(zhì)雙鍵數(shù)目與T2D風(fēng)險的關(guān)系因脂質(zhì)類別而異:DAG、TAG和鞘磷脂中雙鍵越多風(fēng)險越低,而縮醛磷脂中雙鍵增多則風(fēng)險升高。此外,研究還發(fā)現(xiàn)34種脂質(zhì)信號通路代謝物與T2D相關(guān),其中26種為新增關(guān)聯(lián),包括7種膽汁酸(如?;悄懰?、脫氧膽酸)和8種肉堿代謝物。氨基酸、碳水化合物、能量和核苷酸代謝途徑中也有43種代謝物顯著關(guān)聯(lián)T2D,涉及丙氨酸、天冬氨酸、谷氨酸、甘氨酸、絲氨酸、蘇氨酸、尿素循環(huán)、精氨酸、脯氨酸、組氨酸、支鏈氨基酸(BCAA)、色氨酸、賴氨酸、苯丙氨酸和肌酸等關(guān)鍵通路。
通過整合八項隊列的基因組數(shù)據(jù),研究團隊對458種代謝物進行了代謝物數(shù)量性狀基因座(mQTL)分析。在165種T2D相關(guān)代謝物中鑒定出顯著mQTL,其中45%的代謝物-基因座關(guān)聯(lián)為首次發(fā)現(xiàn)。這些mQTL富集的通路與T2D病理機制緊密相關(guān),如脂蛋白代謝、脂聯(lián)素功能、膽汁酸調(diào)控葡萄糖/脂質(zhì)代謝、胰島素反應(yīng)及Rac1激活等。遺傳相關(guān)性分析顯示,T2D相關(guān)代謝物與空腹胰島素、胰島素分泌/敏感性指數(shù)、肝臟酶學(xué)、內(nèi)臟脂肪沉積、肥胖及血脂等T2D相關(guān)表型存在顯著遺傳相關(guān)性,且相關(guān)性強度顯著高于非T2D相關(guān)代謝物。
研究進一步通過共定位分析發(fā)現(xiàn),T2D相關(guān)代謝物的mQTL與47種人體組織中的基因表達顯著共定位,尤其在甲狀腺、食管黏膜、食管-胃交界部、內(nèi)臟脂肪、全血、胰腺和唾液腺等代謝/內(nèi)分泌相關(guān)組織中富集。共定位分析提示,循環(huán)代謝物水平可能反映了多個器官系統(tǒng)(如肝臟、脂肪、胰腺)在T2D發(fā)病中的整合生物學(xué)變化。例如,在GCKR/PPM1G/IFT172基因座,65種代謝物與T2D風(fēng)險共定位,其中61種同時與胰腺中PPM1G、甲狀腺中IFT172和食管-胃交界部中NRBP1的表達共定位。
雙向孟德爾隨機化(MR)分析提示,42種脂質(zhì)和5種氨基酸的遺傳預(yù)測水平與T2D風(fēng)險存在潛在因果關(guān)系,而T2D對代謝物的反向因果效應(yīng)僅見于葡萄糖。去除GCKR、ZNF259和FADS1-3等關(guān)鍵基因座變異后,脂質(zhì)與T2D的關(guān)聯(lián)減弱,表明這些基因在脂質(zhì)代謝與T2D關(guān)聯(lián)中的重要作用。
肥胖(BMI)、體力活動(PA)和飲食等可改變因素對T2D相關(guān)代謝物的影響顯著大于非相關(guān)代謝物。BMI對T2D相關(guān)代謝物變異的解釋度(1.52%)顯著高于非相關(guān)代謝物(0.55%),而行為因素(特別是PA、紅肉、蔬菜和咖啡/茶攝入)共同解釋了T2D相關(guān)代謝物7.73%的變異。中介分析顯示,148種代謝物可能介導(dǎo)BMI與T2D風(fēng)險的關(guān)聯(lián),50種代謝物介導(dǎo)PA與T2D的關(guān)聯(lián)??Х?茶攝入通過74種代謝物(包括復(fù)雜脂質(zhì)、馬尿酸、異亮氨酸和甘氨酸)與較低T2D風(fēng)險相關(guān),而紅肉攝入則通過6種脂質(zhì)介導(dǎo)其與T2D的正相關(guān)。
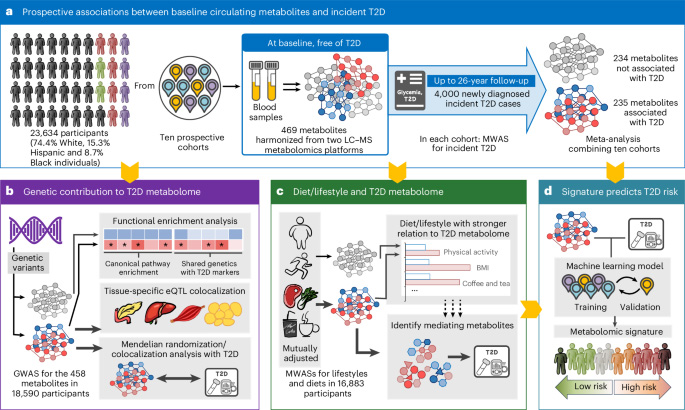
圖2 研究概覽
通過彈性網(wǎng)絡(luò)回歸,研究構(gòu)建了一個包含44種代謝物的標(biāo)志物(包括20種氨基酸、19種脂質(zhì)/能量代謝物和5種其他代謝物),用于預(yù)測T2D風(fēng)險。該標(biāo)志物在獨立驗證隊列中顯示出良好的預(yù)測效能,曲線下面積(AUC)為0.62–0.86,結(jié)合傳統(tǒng)風(fēng)險因素后AUC提升至0.69–0.92。代謝物標(biāo)志物評分最高十分位人群的T2D風(fēng)險是最低十分位的5.07倍。該標(biāo)志物與BMI、紅肉和含糖飲料攝入呈正相關(guān),與PA、全谷物、咖啡/茶和葡萄酒攝入呈負相關(guān),體現(xiàn)了飲食/生活方式因素通過代謝物影響T2D風(fēng)險的潛在途徑。
本研究通過整合多組學(xué)數(shù)據(jù),系統(tǒng)揭示了T2D相關(guān)的代謝物譜系及其遺傳和環(huán)境決定因素,為理解T2D發(fā)病機制提供了新視角。發(fā)現(xiàn)的代謝物標(biāo)志物不僅有助于精準(zhǔn)風(fēng)險分層,還為靶向特定代謝通路的預(yù)防策略提供了生物標(biāo)志物支持。未來研究可在此基礎(chǔ)上進一步探索代謝物在T2D精準(zhǔn)預(yù)防和早期干預(yù)中的應(yīng)用價值。
參考資料
[1] Circulating metabolites, genetics and lifestyle factors in relation to future risk of type 2 diabetes
摘要:研究揭示了遺傳和可調(diào)控因素通過脂代謝、氨基酸、膽汁酸等通路影響T2D發(fā)病機制的分子基礎(chǔ)。
研究團隊對十項前瞻性隊列中23,634名基線無T2D的參與者進行了長達26年的隨訪,共發(fā)現(xiàn)4,000例新發(fā)T2D病例。通過檢測469種血液代謝物,鑒定出235種與T2D風(fēng)險顯著相關(guān)的代謝物(錯誤發(fā)現(xiàn)率FDR<0.05),包括67種此前未報告的關(guān)聯(lián)代謝物,涉及膽汁酸、脂質(zhì)、肉堿、尿素循環(huán)、精氨酸/脯氨酸、甘氨酸和組氨酸等代謝途徑。多因素調(diào)整后,除葡萄糖外,代謝物與T2D的風(fēng)險比(RR)范圍為0.67(C22:4膽固醇酯)至1.71(C32:0二?;视停?。敏感性分析和不同種族/民族亞組分析結(jié)果一致,凸顯了這些代謝物關(guān)聯(lián)的穩(wěn)健性。

圖1 PARP抑制通過轉(zhuǎn)錄與代謝重編程促進CD8+中央記憶性T細胞擴增
在復(fù)雜脂質(zhì)類別中,130種脂質(zhì)與T2D風(fēng)險相關(guān),包括與能量儲存相關(guān)的三酰基甘油(TAG)、參與胰島素抵抗信號激活的二酰基甘油(DAG)、促進β細胞凋亡的神經(jīng)酰胺,以及與胰島素抵抗相關(guān)的磷脂酰膽堿(PC)、磷脂酰乙醇胺(PE)和磷脂酰肌醇等。相反,膽固醇酯(CE)、溶血磷脂、不飽和磷脂縮醛及部分鞘磷脂與較低T2D風(fēng)險相關(guān)。脂質(zhì)雙鍵數(shù)目與T2D風(fēng)險的關(guān)系因脂質(zhì)類別而異:DAG、TAG和鞘磷脂中雙鍵越多風(fēng)險越低,而縮醛磷脂中雙鍵增多則風(fēng)險升高。此外,研究還發(fā)現(xiàn)34種脂質(zhì)信號通路代謝物與T2D相關(guān),其中26種為新增關(guān)聯(lián),包括7種膽汁酸(如?;悄懰帷⒚撗跄懰幔┖?種肉堿代謝物。氨基酸、碳水化合物、能量和核苷酸代謝途徑中也有43種代謝物顯著關(guān)聯(lián)T2D,涉及丙氨酸、天冬氨酸、谷氨酸、甘氨酸、絲氨酸、蘇氨酸、尿素循環(huán)、精氨酸、脯氨酸、組氨酸、支鏈氨基酸(BCAA)、色氨酸、賴氨酸、苯丙氨酸和肌酸等關(guān)鍵通路。
通過整合八項隊列的基因組數(shù)據(jù),研究團隊對458種代謝物進行了代謝物數(shù)量性狀基因座(mQTL)分析。在165種T2D相關(guān)代謝物中鑒定出顯著mQTL,其中45%的代謝物-基因座關(guān)聯(lián)為首次發(fā)現(xiàn)。這些mQTL富集的通路與T2D病理機制緊密相關(guān),如脂蛋白代謝、脂聯(lián)素功能、膽汁酸調(diào)控葡萄糖/脂質(zhì)代謝、胰島素反應(yīng)及Rac1激活等。遺傳相關(guān)性分析顯示,T2D相關(guān)代謝物與空腹胰島素、胰島素分泌/敏感性指數(shù)、肝臟酶學(xué)、內(nèi)臟脂肪沉積、肥胖及血脂等T2D相關(guān)表型存在顯著遺傳相關(guān)性,且相關(guān)性強度顯著高于非T2D相關(guān)代謝物。
研究進一步通過共定位分析發(fā)現(xiàn),T2D相關(guān)代謝物的mQTL與47種人體組織中的基因表達顯著共定位,尤其在甲狀腺、食管黏膜、食管-胃交界部、內(nèi)臟脂肪、全血、胰腺和唾液腺等代謝/內(nèi)分泌相關(guān)組織中富集。共定位分析提示,循環(huán)代謝物水平可能反映了多個器官系統(tǒng)(如肝臟、脂肪、胰腺)在T2D發(fā)病中的整合生物學(xué)變化。例如,在GCKR/PPM1G/IFT172基因座,65種代謝物與T2D風(fēng)險共定位,其中61種同時與胰腺中PPM1G、甲狀腺中IFT172和食管-胃交界部中NRBP1的表達共定位。
雙向孟德爾隨機化(MR)分析提示,42種脂質(zhì)和5種氨基酸的遺傳預(yù)測水平與T2D風(fēng)險存在潛在因果關(guān)系,而T2D對代謝物的反向因果效應(yīng)僅見于葡萄糖。去除GCKR、ZNF259和FADS1-3等關(guān)鍵基因座變異后,脂質(zhì)與T2D的關(guān)聯(lián)減弱,表明這些基因在脂質(zhì)代謝與T2D關(guān)聯(lián)中的重要作用。
肥胖(BMI)、體力活動(PA)和飲食等可改變因素對T2D相關(guān)代謝物的影響顯著大于非相關(guān)代謝物。BMI對T2D相關(guān)代謝物變異的解釋度(1.52%)顯著高于非相關(guān)代謝物(0.55%),而行為因素(特別是PA、紅肉、蔬菜和咖啡/茶攝入)共同解釋了T2D相關(guān)代謝物7.73%的變異。中介分析顯示,148種代謝物可能介導(dǎo)BMI與T2D風(fēng)險的關(guān)聯(lián),50種代謝物介導(dǎo)PA與T2D的關(guān)聯(lián)??Х?茶攝入通過74種代謝物(包括復(fù)雜脂質(zhì)、馬尿酸、異亮氨酸和甘氨酸)與較低T2D風(fēng)險相關(guān),而紅肉攝入則通過6種脂質(zhì)介導(dǎo)其與T2D的正相關(guān)。

圖2 研究概覽
通過彈性網(wǎng)絡(luò)回歸,研究構(gòu)建了一個包含44種代謝物的標(biāo)志物(包括20種氨基酸、19種脂質(zhì)/能量代謝物和5種其他代謝物),用于預(yù)測T2D風(fēng)險。該標(biāo)志物在獨立驗證隊列中顯示出良好的預(yù)測效能,曲線下面積(AUC)為0.62–0.86,結(jié)合傳統(tǒng)風(fēng)險因素后AUC提升至0.69–0.92。代謝物標(biāo)志物評分最高十分位人群的T2D風(fēng)險是最低十分位的5.07倍。該標(biāo)志物與BMI、紅肉和含糖飲料攝入呈正相關(guān),與PA、全谷物、咖啡/茶和葡萄酒攝入呈負相關(guān),體現(xiàn)了飲食/生活方式因素通過代謝物影響T2D風(fēng)險的潛在途徑。
本研究通過整合多組學(xué)數(shù)據(jù),系統(tǒng)揭示了T2D相關(guān)的代謝物譜系及其遺傳和環(huán)境決定因素,為理解T2D發(fā)病機制提供了新視角。發(fā)現(xiàn)的代謝物標(biāo)志物不僅有助于精準(zhǔn)風(fēng)險分層,還為靶向特定代謝通路的預(yù)防策略提供了生物標(biāo)志物支持。未來研究可在此基礎(chǔ)上進一步探索代謝物在T2D精準(zhǔn)預(yù)防和早期干預(yù)中的應(yīng)用價值。
參考資料
[1] Circulating metabolites, genetics and lifestyle factors in relation to future risk of type 2 diabetes



